موازنة المعادلات الكيميائية من الدروس المهمة التي تحتاج إلى شرح مفصل. حل المعادلات الكيميائية وموازنتها تتطلب المتفاعلات من أجل الحصول على النواتج. لا تحتاج إلى أي برنامج موازنة المعادلات الكيميائية بعد ان تتابع هذه الصفحة والشرح المبسط الذي يعتبر تمهيدا لشروحات اكبر. الكثير من الطلبة العرب يبحثون عن طريقة او كيفية موازنة المعادلات الكيميائية لغرض ضبطها وحلها في الامتحانات وفهمها بشكل دقيق ومنهم أصحاب الاختصاص في الجامعات. سوف تتضمن هذه الصفحة تمارين وحلول تخص موازنة المعادلات الكيميائية من أجل تبسيط العملية. كل هذه الصفحة سوف تعتبر في النهاية ورقة عمل عن موازنة المعادلات الكيميائية.
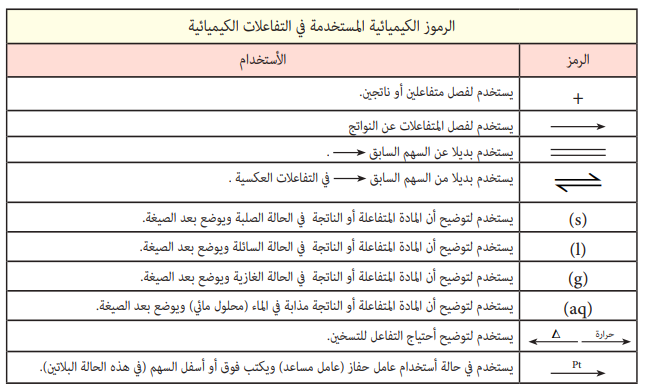
لماذا نحتاج إلى موازنة المعادلات الكيميائية ؟
ان المعادلة الكيميائية تشبه الميزان ذو الكفتين، إذ ما يوضع وكفته اليسرى يجب أن يعادل ما يوضع في كفته اليمنى ليكون الميزان متوازن. فمثلا تفاعل الكلور مع غاز الهيدروجين ينتج عنه غاز كلوريد الهيدروجين، وعند تمثيل هذا التفاعل بمعادلة كيميائية رمزية کالاتي :
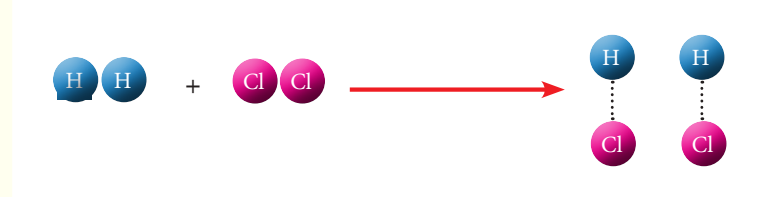
H2 + Cl2 ———> HCl
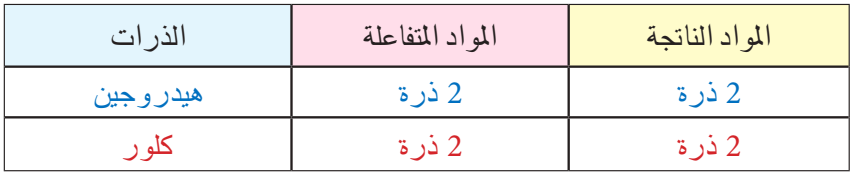
نلاحظ أن جزيء غاز الهيدروجين يتكون من ذرتين وكذلك جزيء غاز الكلور يتكون من ذرتين. أما ناتج التفاعل جزيء كلوريد الهيدروجين فيتكون من ذرة كلور وذرة هيدروجين أي أن هنالك ذرة هيدروجين وذرة كلور لم نعبر عنها في ناتج التفاعل. من هذه الخطوات سوف تتضح لنا اسهل اساليب موازنة المعادلات الكيميائية . وعلى أساس قاعدة الميزان يمكن تمثيل التفاعل الكيميائي كالاتي :
H2 + Cl2 ———> HCl +HCl
أو نستخدم الاختصار كالاتي :
H2 + Cl2 ———> 2HCl
من هذه المعادلة نجد أننا لنزن المعادلة السابقة يجب أن نضرب الناتج × 2. وللتأكد من صحة موازنة المعادلة نتأكد من مجموع عدد ذرات كل عنصر في المعادلة:
الفكرة الرئيسة:
موازنة المعادلة الكيميائية طريقة حسابية يتم من خلالها جعل مجموع عدد ذرات كل عنصر في طرفي المعادلة متساويا.
نتاجات التعلم: في نهاية هذا المقال سأكون قادرا على أن :
- أوضح كيفية موازنة ذرات كل عنصر في المعادلة الكيميائية.
- أستنتج أن مجموع ذرات العناصر المتفاعلة مساوية لمجموعها في المواد الناتجة.
- أزن بعض المعادلات الكيميائية.
المفردات:
- المعادلة الكيميائية Chemical equation
- موازنة المعادلات الكيميائية Balance of chemical equation
والان لنزن التفاعل الآتي:
H2+O2 ———> H2O
نلاحظ أن جزيء هيدروجين متكون من ذرتي هيدروجين تفاعلت مع جزيء أوكسجين متكون من ذرتي أوكسجين فكان الناتج جزيء ماء متكون من ذرتي هيدروجين وذرة أوكسجين أي أن هناك ذرة أوكسجين لم تمثل في الناتج أو بعبارة أدق أن المعادلة غیر موزونة، هنا نضاعف أو جزيء الناتج لتصبح المعادلة كالاتي:

ومن حساب عدد ذرات العناصر في جزيء الماء بعد الضرب نجد ان عدد ذرات الأوكسجين اصبحت اثنتين اما ذرات الهيدروجين اصبحت اربعين، ولتصبح المعادلة موزونة يجب ان نضاعف عدد جزيئات الهيدروجين الداخلة في التفاعل لتتضاعف عدد ذراتها بالتالي:

2H2 + O2 ————> 2H2O
من هذا نجد أن موازنة المعادلة الكيميائية طريقة حسابية يتم من خلالها جعل مجموع عدد ذرات كل عنصر في طرفي المعادلة متساويا. وللتاكد من صحة موازنة المعادلة نتاكد من مجموع عدد ذرات كل عنصر في المعادلة:

طريقة موازنة المعادلات الكيميائية
أولا: نحسب عدد ذرات كل عنصر في المواد المتفاعلة وعدده في المواد الناتجة مثلا:
N2 + H2 ———-> NH3
.
جزيء النتروجين اشتركت منه ذرتان وجزيء الهيدروجين اشتركت منه ذرتان اما جزيء الأمونيا تكون من ذرة نتروجين وثلاث ذرات من الهيدروجين
ثانيا : عند وجود عنصر عدد ذراته مختلف في طرفي المعادلة نوازنه أولا بمضاعفة العدد الاقل كما في النتروجين نضاعفه أولا وذلك بضرب جزيء الأمونيا بالعدد 2 فتصبح المعادلة:
N2 + H2 ———-> 2MH3
ثالثا: نلاحظ بعد الخطوة الثانية العناصر الأخرى في الجزيء التي ضاعفتها هل تغير مجموع ذراتها عن الطرف الاخر من المعادلة . هنا نجد أن الهيدروجين اصبح مجموع ذراته 6 في النواتج ولكن كمادة متفاعلة بقي 2 لذلك يجب أن نضرب جزيئته برقم ليصبح متساويا من الطرف الاخر وهنا يكون الجواب الصحيح 3 تصبح المعادلة:
N2 + 3H2 ———-> 2NH3
وعند حساب عدد ذرات العناصر في المواد المتفاعلة والمواد الناتجة نجد: ست ذرات من الهيدروجين و ذرتين من النتروجين اشتركت في التفاعل ونتج من التفاعل ايضا ست ذرات من الهيدروجين و ذرتين من النتروجين من هذا نجد انه لا يحدث خسران في كميات المواد التي تشترك في التفاعل حيث ينتج عنها ما يساويها في النواتج . هذا الجدول يبين موازنة المعادلات الكيميائية المشروحة اعلاه.

سؤال: عند احتراق الصوديوم يتكون أوكسيد الصوديوم ، عبر عن ذلك بمعادلة كيميائية رمزية موزونة ، ونظمها كما في الجدول اعلاه.
مثال اخر على موازنة المعادلات الكيميائية
وعند اخذ مثال اخر كتفاعل يوديد البوتاسيوم والبروم لتكوين بروميد البوتاسيوم واليود تكتب المعادلة الرمزية كالاتي:
KI + Br2 ———-> KBr +I2
نلاحظ من المعادلة الرمزية أنه توجد ذرة بوتاسيوم وذرة يود وذرتا بروم في الطرف الأيسر من المعادلة. أما في الطرف الأيمن هناك ذرة بروم وذرة بوتاسيوم وذرتا بود. آن ذرات العناصر المتغيرة هي اليود والبروم اعدادها غير متساوية في طرفي المعادلة لذا نضاعف عدد ذرات اليود في الطرف الأيسر بضرب KI بالرقم 2.
2KI + Br2 ———-> KBr +I2
ونضرب KBr في الطرف الأيمن بالعدد 2 فتصبح المعادلة موزونة كالاتي:
2KI + Br2 ———-> 2KBr +I2
أما عند احتراق الكاربون يتكون غاز ثنائي أوكسيد الكاربون ، ويمكن التعبير عن التفاعل بالمعادلة الكيميائية الآتية:
C + O2 ———-> CO2
نلاحظ ان عدد ذرات العناصر المشتركة في المعادلة هي ثلاث، ذرة كاربون وذرتا أوكسجين، أما في نواتج المعادلة توجد ذرة كاربون و ذرتا أوكسجين، أي أن المعادلة موزونة ولذا لا تحتاج إلى موازنة. وهي تعتبر اسهل طرق موازنة المعادلات الكيميائية.
سؤال: بين عدد الذرات والجزيئات للمواد المتفاعلة والناتجة للتفاعل المعبر عنه بالمعادلة الكيميائية الموزونة الآتية: P4 + 6H2 ———-> 4PH3
إضافة تعليق
يجب عليك تسجيل الدخول او التسجيل لتستطيع اضافه تعليق .